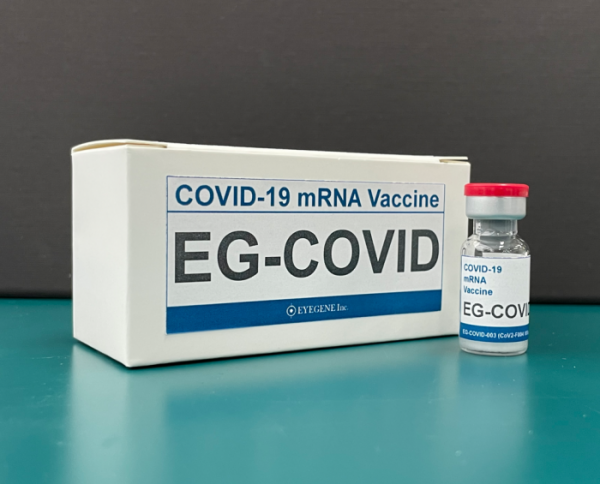
아이진은 자체 기술로 개발한 코로나19 mRNA백신 EG-COVID의 국내 임상 1상 시험 결과 보고서(CSR, Clinical Study Report)를 수령함으로써 임상 1상의 전 과정이 마무리됐다고 12일 공시했다.
이번 보고서는 코로나19 바이러스 관련 시판 백신을 한 번도 접종한 이력이 없는 국내 건강한 성인 총 45명을 15명씩 3개의 군으로 나눠 각 mRNA 용량 기준으로 저용량(50㎍), 중용량(100㎍), 고용량(200㎍)의 EG-COVID를 2회 투여 후 52주 시점까지 기초 접종으로서의 안전성 및 면역원성을 확인한 임상 1상의 최종 결과를 담았다.
아이진은 임상을 통해 EG-COVID의 안전성을 관찰한 결과, 백신 접종과 직접적인 연관성이 있는 부작용이나 심각한 이상 반응에 관한 보고가 없음을 검증했다. 또한, 유효성 측정 지표인 면역원성 결과로 pVNT(Neutralizing Antibody Test, 바이러스 중화력 테스트)를 통한 혈청 중화항체 분석에서 중용량과 고용량군에서 의미 있는 항체양전율을 확인했다. 이 중 고용량 투여군의 절반 정도에서 항체양전율이 증가해 투여 용량이 늘수록 항체양전율이 증가하는 경향성을 확인했다.
ELISA 분석법을 통해 RBD(Receptor Binding Domain) Protein에 대한 특이적인 IgG 면역 분석을 실시한 결과에서도 EG-COVID 2차 투여 후 4주 시점에서 모든 투여군에서 기하평균농도, 기하평균증가율, 항체양전율의 증가가 관찰됐다.
아이진 관계자는 “이번 임상 시험 결과를 통해 아이진의 자체 기술로 개발된 EG-COVID가 부작용 없이 안전하며 인체 내에서 백신의 기능이 잘 작동되고 있는 것을 확인했다”라면서 “이는 호주에서 진행 중인 EG-COVID와 오미크론 변이 바이러스 전용 대응 백신(EG-COVARo)의 부스터 임상 결과 및 임상 진입을 앞둔 다가백신 개발이 성공 가능성을 뒷받침한다”라고 말했다.



![1인 가구 청년들을 위한 다양한 소통 프로그램 '건강한 밥상' [십분청년백서]](https://img.etoday.co.kr/crop/140/88/2096058.jpg)
![서울에는 김밥·구미에는 라면…주말 분식 축제 [그래픽 스토리]](https://img.etoday.co.kr/crop/140/88/2096164.jpg)

![“금투세, 폐지 대신 공제 늘리자”…野 ‘절충 법안’ 속속 발의 [관심法]](https://img.etoday.co.kr/crop/140/88/2096148.jpg)
![尹, 北ICBM 발사에 "강력 대응"…고체연료 주요 부품 北 수출 금지[종합2보]](https://img.etoday.co.kr/crop/140/88/2095889.jpg)



![2차전지 새로운 주도주 등장하나, 분야별 탑픽은 '이것' ㅣ 이창환 iM증권 영업부장 [찐코노미]](https://i.ytimg.com/vi/ZiFpzTXCCMY/mqdefault.jpg)



![[BioS]에이비엘, 월드ADC서 ‘이중항체 ADC’ “개발전략 발표”](https://img.etoday.co.kr/crop/85/60/2096317.jpg)
![GS25 ‘무무씨와 친구들’ㆍ메밀단편 ‘메밀요리 3종’ 외 [나왔다 신상]](https://img.etoday.co.kr/crop/85/60/2096228.jpg)





![서울에는 김밥·구미에는 라면…주말 분식 축제 [그래픽 스토리]](https://img.etoday.co.kr/crop/300/170/2096164.jpg)
![함용일 금감원 부원장, 고려아연 경영권 분쟁 등 자본시장 현안 관련 브리핑 [포토]](https://img.etoday.co.kr/crop/300/190/2096151.jpg)