지난해에 이어 올해도 국내 기업이 개발한 ‘국산 신약’의 품목허가 낭보가 이어질 전망이다. 특히 그동안 외국계 기업의 품목에 의존했던 희귀 혈액암 세포치료제와 비만치료제 국산화 여부에 대한 기대감이 모이고 있다.
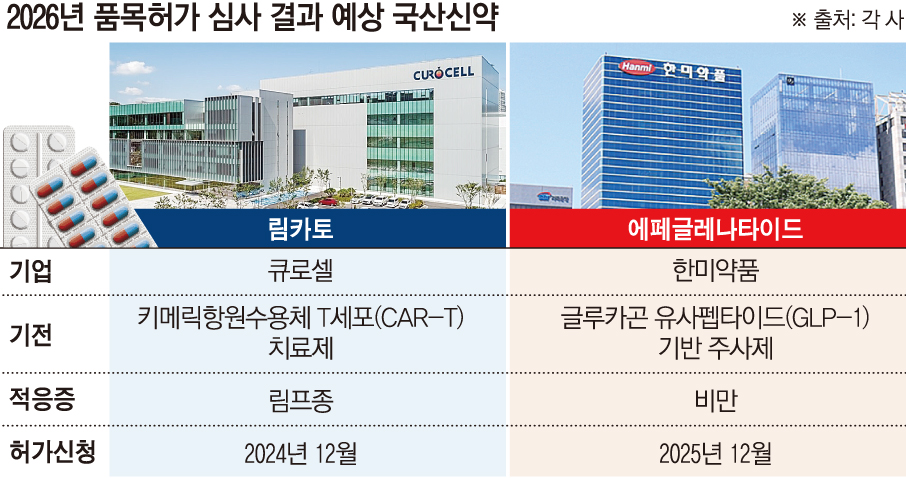
6일 제약바이오 업계에 따르면 올해 큐로셀과 한미약품 등이 개발한 신약이 식품의약품안전처로부터 품목허가를 받을 것으로 예상된다. 큐로셀은 키메릭항원수용체 T세포(CAR-T) 치료제 ‘림카토’를, 한미약품은 글루카곤유사펩타이드-1(GLP-1) 기반 비만치료제 ‘에페글레나타이드 오토인젝터주’의 허가심사 결과를 기다리고 있다. 허가가 이뤄지면 각각 42호, 43호 국산신약 타이틀을 얻게 된다.
큐로셀은 2024년 12월 림카토의 허가신청을 접수한 바 있다. 지금까지 CAR-T 치료제의 허가신청 접수부터 승인까지 소요된 기간은 짧게는 7개월에서 길게는 1년 2개월이었던 만큼, 림카토의 심사 결과가 올해 안으로 나올 가능성이 크다. 특히 림카토는 식약처의 글로벌 혁신제품 신속심사(GIFT) 대상으로 지정돼, 전담 심사팀 배정, 맞춤형 심사, 우선 심사 등의 혜택을 적용받았다.
CAR-T 치료제는 환자의 혈액에서 면역세포의 일종인 T세포를 채취해 암세포만 선택적으로 공격하도록 유전자를 변형한 뒤 다시 환자에게 주입하는 기술이다. 림카토의 치료 대상 질환은 혈액암의 일종인 재발성 또는 불응성 거대B세포림프종(LBCL)이다.
림카토는 LBCL 환자 대상 임상 2상에서 암이 모두 없어지는 완전관해(CR) 67.1%를 기록해 경쟁 제품의 수치(40%)를 크게 상회한 바 있다. 중앙값 무진행 생존기간(mPFS)은 6.0개월로 경쟁 제품(2.9개월)의 두 배로 나타났다.
림카토가 승인을 받으면 국내 시장에서 유일한 국산 CAR-T 치료제가 된다. 현재 국내 허가된 CAR-T 치료제는 노바티스의 ‘킴리아’, 존슨앤존슨의 ‘카빅티’, 길리어드사이언스의 ‘예스카타’ 등 3개 품목이다. 이 가운데 킴리아는 2022년부터 건강보험 급여가 적용되고 있다.
한미약품이 개발한 비만 치료제 신약 에페글레나타이드는 지난해 말 식약처에 허가신청이 접수됐다. 에페글레나타이드 역시 식약처로부터 GIFT 대상으로 지정된 바 있다. 한미약품은 올해 해당 물질의 품목허가를 획득해 하반기 중으로 제품을 국내 출시한다는 목표다.
에페글레나타이드는 한국인 448명을 대상으로 실시한 임상 3상에서 투약 40주차에 최대 30%에 이르는 체중 감량 효과를 입증했다. 이상사례 발현율은 메스꺼움 16.72%, 구토 11.71%, 설사 17.73%로 나타나 경쟁 제품 대비 낮은 수치를 보였다.
현재 국내 비만 치료제 자가주사제 시장은 GLP-1 기반의 비만 치료제인 노보노디스크의 ‘위고비’와 일라이 릴리가 개발한 위억제 펩타이드(GIP)·GLP-1 이중작용 기전의 ‘마운자로’가 각각 시장을 선점하고 있다. 에페글레나타이드는 유일하게 국내 생산되는 국산 제품으로서 가격 경쟁력을 확보해 시장 점유에 나설 것으로 예상된다.
앞서 지난해에는 GC녹십자의 탄저균 백신 ‘배리트락스’(39호), 메디톡스의 지방분해 주사제 ‘뉴비쥬’(40호), SK바이오팜의 뇌전증 치료제 ‘엑스코프리’(41호)까지 총 세 품목의 국산 신약이 탄생했다.
배리트락스는 GC녹십자가 질병관리청과 공동으로 개발한 세계 최초 재조합 단백질 탄저백신이다. 뉴비쥬는 메디톡스의 첫 케미컬 신약이자, 세계 최초로 콜산(CA)을 주성분으로 개발된 차세대 지방분해주사제다. SK바이오팜은 엑스코프리의 국내 허가에 앞서 2019년 미국, 2021년 유럽, 2023년 캐나다에서 먼저 허가를 취득해 출시했다.

![[상보] 삼성전자, 작년 4분기 영업이익 20조⋯전년비 208% ↑](https://img.etoday.co.kr/crop/140/88/2259680.jpg)
![[단독] "넥슨 인수 안 한다”던 中 텐센트, 전략 수정…K게임 삼키기 ‘눈독’](https://img.etoday.co.kr/crop/140/88/2278578.jpg)




![[단독] 李 '공공기관 개혁' 속도전 주문 속…'통폐합 1순위' 신보, 존치 명분 얻었다](https://img.etoday.co.kr/crop/140/88/2278569.jpg)




![2026년 현대차 주가 '여기' 간다? 주가 전망 솔직히 말씀드립니다 ㅣ 윤석천 경제평론가 [찐코노미]](https://i.ytimg.com/vi/6YBOxg_KxtE/mqdefault.jpg)
![[인터뷰] “현대차그룹만의 제조 현장에서 검증되는 로봇 생태계 구축할 것” [CES 2026]](https://img.etoday.co.kr/crop/85/60/2278632.jpg)
![글로벌 AI 전쟁 車 부품사로도 확전…현대모비스·현대위아 집결 [CES 2026]](https://img.etoday.co.kr/crop/85/60/2278630.jpg)
![[상보]삼성전자, 작년 4분기 영업익 20조⋯'역대 최대ㆍ국내 최초'](https://img.etoday.co.kr/crop/85/60/2259680.jpg)
![[CEO 인터뷰] 김녹원 딥엑스 대표 “글로벌 고객사 양산 본격화의 해” [CES 2026]](https://img.etoday.co.kr/crop/85/60/2278648.jpg)

![박정원 두산그룹 회장 “맞춤형 에너지 솔루션으로 AI 시대 에너지 시장 선도” [CES 2026]](https://img.etoday.co.kr/crop/85/60/2278643.jpg)

![현대차그룹 제로원, 스타트업 혁신 기술 전면에 [CES 2026]](https://img.etoday.co.kr/crop/85/60/2278624.jpg)

![엑소→BTS 컴백으로 끝?⋯K-콘텐츠, 다시 증명해야 할 시간 [이슈크래커]](https://img.etoday.co.kr/crop/300/170/2278513.jpg)
![더불어민주당 최고위원 후보자 토론회 [포토로그]](https://img.etoday.co.kr/crop/300/190/2278559.jpg)