셀트리온에 따르면 당초 미국 식품의약국(FDA)은 임상 1상과 2상, 3상 임상까지 모두 진행할 것을 요구했으나 셀트리온 측이 그동안의 유럽의약청(EMA) 에 제출한 방대한 임상 데이터를 제시하며 축소를 제안했다. 그 결과 임상 1상과 2상 임상을 면제받고 3상 임상만 진행하기로 최종 합의했다.
셀트리온은 임상시험 단계 축소를 통해 개발비용을 절감하는 것은 물론 미국 시장에도 조기에 진입할 수 있을 것으로 보고 있다.
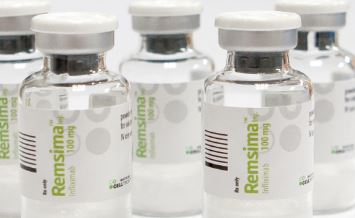
램시마는 인플릭시맙 성분의 자가면역질환 치료용 바이오시밀러다. 류머티즘 관절염, 염증성 장질환 등에 사용한다. 오리지널 의약품 '레미케이드'와 동일한 정맥주사 제형으로 개발됐다.
램시마SC는 셀트리온이 판매 중인 램시마의 제형을 정맥주사형에서 피하주사형으로 바꾼 제품으로, 지난해 말 글로벌 임상3상을 마치고 EMA에 판매허가를 신청했다. 피하 주사 제형은 환자가 매번 병원을 찾아야 하는 정맥주사와 달리 환자 스스로 주사할 수 있어 편의성이 높다.
램시마SC는 오리지널 의약품인 존슨앤드존슨의 ‘레미케이드’를 위협할만한 가장 강력한 경쟁자로 꼽힌다. 레미케이드는 정맥주사형밖에 없어 피하주사형 제품에 대한 글로벌 수요가 상당할 것으로 예상된다.
셀트리온은 FDA의 임상시험 승인 후 염증성 장질환(IBD) 환자를 대상으로 미국 3상 임상을 먼저 진행한 후 향후 3상 임상을 세계 각국으로 확대할 계획이다. 이후 2021년 글로벌 임상 3상을 마무리하고, 2022년에는 미국 FDA 승인을 얻는 것을 목표로 잡고 있다.

!['얼굴 천재' 차은우 사라졌다⋯스타 마케팅의 불편한 진실 [솔드아웃]](https://img.etoday.co.kr/crop/140/88/2285920.jpg)

![5월 10일, 다주택자 '세금 폭탄' 터진다 [이슈크래커]](https://img.etoday.co.kr/crop/140/88/2284673.jpg)
![‘가성비’ 수입산 소고기, 한우 가격 따라잡나 [물가 돋보기]](https://img.etoday.co.kr/crop/140/88/2285900.jpg)
![삼성전자·현대차 목표가 상승…'깐부회동' 이후 샀다면? [인포그래픽]](https://img.etoday.co.kr/crop/140/88/2285821.jpg)

















!['얼굴 천재' 차은우 사라졌다⋯스타 마케팅의 불편한 진실 [솔드아웃]](https://img.etoday.co.kr/crop/300/170/2285920.jpg)
![코스피 종가 기준 사상 최고치 기록... 4990선 상승 마감 [포토로그]](https://img.etoday.co.kr/crop/300/190/2285941.jpg)