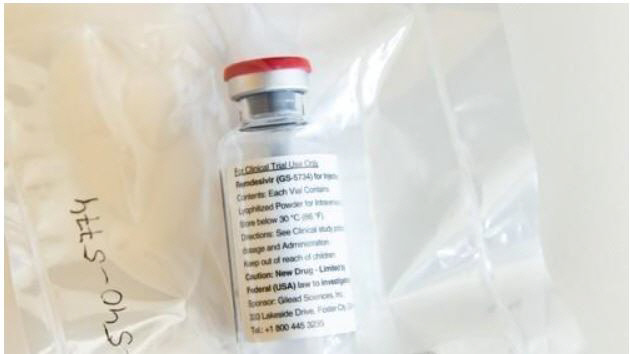
길리어드사이언스의 ‘렘데시비르’가 신종 코로나바이러스 감염증(코로나19)에 대한 효과를 확인하면서 치료제 개발 시장이 들썩이고 있다. 렘데시비르가 가장 빠른 개발 속도를 무기로 코로나19 종식을 끌어낼 수 있을지 주목된다.
6일 업계에 따르면 렘데시비르는 코로나19 중증 환자를 위한 치료제로 급부상했다. 그간 불거진 논란과 달리 긍정적인 임상 데이터를 잇달아 내놓은 덕분이다.
길리어드가 발표한 임상 톱라인 데이터에 따르면 렘데시비르를 각각 5일(200명)과 10일(197명) 동안 투여한 코로나19 중증 환자는 양쪽 모두 증상 개선의 효과가 확인됐다. 렘데시비르 투여 후 14일째 되던 날 질환개선 척도가 2단계 이상 개선된 환자의 비율은 5일 투여군에서는 64.5%, 10일 투여군에서는 53.8%로 나타났다. 퇴원 환자의 비율은 5일 투여군에서는 60%, 10일 투여군에서는 52.3%로 효능의 차이가 없었다. 즉, 5일만 투여해도 효능을 확인할 수 있다는 얘기다. 이탈리아를 제외한 지역에서 14일째 치사율은 7%였다.
이어서 발표된 미국 국립알레르기·감염병연구소(NIAID)의 렘데시비르 임상 결과도 고무적이었다. 1063명의 환자를 대상으로 렘데시비르 투여군과 위약 투여 대조군을 비교한 결과 렘데시비르가 치료 기간을 15일에서 11일로 단축했다.
연이은 희소식을 가장 반긴 곳은 미국이다. 미국은 사망자가 10만 명에 달할 것으로 예상돼 코로나19 피해가 가장 큰 국가 중 하나다. 미국 식품의약국(FDA)은 1일(현지시간) 코로나19 중증 환자에 대한 렘데시비르의 긴급사용승인(EUA)을 허가했다. EUA는 생명을 위협하는 질병에 대해 치료제가 없는 경우 정식 허가를 받지 않은 의약품을 응급 상황에서 사용할 수 있도록 허용하는 제도다.
업계 관계자는 “렘데시비르가 코로나19를 완치할 수 있는 약은 아니지만, 중증 환자의 회복 속도를 높여준다는 점에서 공포심을 완화할 수 있다”고 말했다. 중증 환자의 회복이 빨라지면 퇴원 시기를 앞당겨 병실 부족 문제를 해결할 수 있고, 가을에 재유행해도 위험을 낮춰줄 수 있다는 설명이다.
각국도 렘데시비르 사용 채비를 서두르고 있다. 유럽의약품청(EMA)은 렘데시비르의 코로나19 치료 효과에 대한 동반 심사에 들어갔다. 동반 심사는 공중보건 비상 상황에서 유망한 임상시험용 의약품의 평가를 가속하는 절차다.
일본도 렘데시비르를 치료제로 조기 사용할 수 있는 특례승인 절차에 착수했다. 길리어드가 렘데시비르의 사용을 신청하면 1주일 이내에 승인할 수 있도록 시행령을 개정하는 것이다.
그러나 우리 방역당국은 렘데시비르가 코로나19 환자에게 광범위하게 사용되기는 어려울 것으로 봤다. 권준욱 중앙방역대책본부 부본부장은 전날 정례브리핑에서 “신종플루 유행 당시 타미플루처럼 초기에 모든 환자에 투약해 전파력을 낮추는 등의 방역 대책을 진행할 정도의 의미는 가지지 못한 것으로 파악한다”고 말했다.
식품의약품안전처도 아직 렘데시비르의 임상시험이 끝나지 않아 코로나19 치료제로서 안전성ㆍ유효성을 판단할 단계가 아니란 입장이다. 식약처는 렘데시비르의 치료 기대 효과가 안전성을 웃돌 경우 특례수입 등을 통해 코로나19 환자에게 사용할 수 있다는 방침을 내놨다.
미국 FDA의 렘데시비르 긴급사용 승인은 전 세계 코로나19 치료제 개발 판도에 변화를 가져올 것으로 전망된다. 길리어드는 12월까지 100만 병 분량을 생산할 계획이다. 미국 임상경제평가연구소(ICER)는 렘데시비르의 생산 비용을 10달러로 책정했으나, 임상 데이터에 따라 가격이 4500달러(약 550만 원)까지 상승할 것으로 추산했다. 길리어드는 코로나19 피해가 심각한 지역을 중심으로 우선 150만 바이알을 기부하기로 했다. 14만 명에게 투여할 수 있는 분량이다.
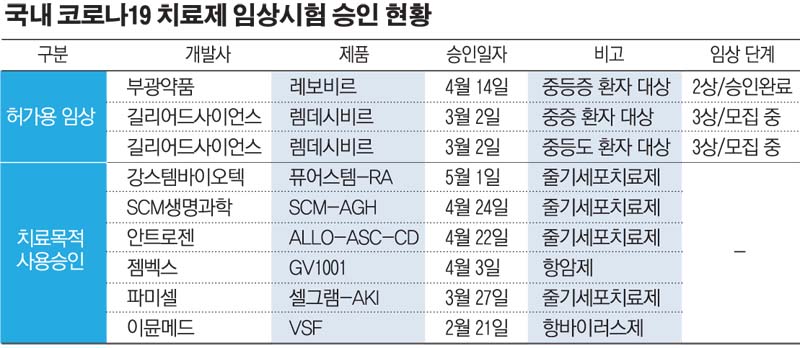
렘데시비르가 상용화에 속도를 내면서 국내 제약ㆍ바이오기업들이 개발 중인 코로나19 치료제가 수익성을 담보하기 어렵다는 우려도 불거진다. 현재 국내에서는 셀트리온, GC녹십자, 부광약품, 대웅테라퓨틱스, 셀리버리, 코미팜, 신풍제약, 앱클론, 유틸렉스 등이 다양한 방식으로 치료제 개발에 박차를 가하고 있다.
이 가운데 국내 임상을 허가받은 기업은 항바이러스제 ‘레보비르’를 신약 재창출 방식으로 개발 중인 부광약품뿐이다. 8월께 임상 데이터를 발표할 계획이다. 이명선 신영증권 연구원은 “레보비르는 오랜 처방 데이터를 바탕으로 안전성에 크게 문제가 없을 것으로 보여 긍정적인 임상 결과가 나온다면 경쟁력이 있다”면서도 “렘데시비르와 같은 글로벌 임상 데이터가 없어 파급력에는 한계가 있을 것”이라고 진단했다.
혈장 치료제를 개발하고 있는 GC녹십자는 7월 중 임상 착수를 목표로 오창공장에서 시험 생산을 마쳤다. 셀트리온은 항체 치료제 개발 기간을 최대한 단축해 7월 중 임상시험에 돌입할 계획이다. 그 밖의 기업은 임상 진입까지 좀 더 시간이 필요하다.
다만, 아직 렘데시비르가 완전한 효과를 증명한 것은 아니란 점에서 국내 기업들에도 기회가 있을 수 있다. 렘데시비르는 환자들의 회복 속도를 개선했지만, 치명률을 낮출 수 있을지는 추가 연구가 뒤따라야 한다. 길리어드는 임상을 확장해 5600명의 환자를 추가 등록 중이다. 중등증 환자 대상 연구 결과는 5월 말에 발표된다.

![삼성전자·현대차 목표가 상승…'깐부회동' 이후 샀다면? [인포그래픽]](https://img.etoday.co.kr/crop/140/88/2285848.jpg)

![5월 10일, 다주택자 '세금 폭탄' 터진다 [이슈크래커]](https://img.etoday.co.kr/crop/140/88/2284673.jpg)
![‘가성비’ 수입산 소고기, 한우 가격 따라잡나 [물가 돋보기]](https://img.etoday.co.kr/crop/140/88/2285900.jpg)
!['얼굴 천재' 차은우 사라졌다⋯스타 마케팅의 불편한 진실 [솔드아웃]](https://img.etoday.co.kr/crop/140/88/2285920.jpg)













![위고비·마운자로 다이어트 열풍…담석증 위험 어쩌나[e건강~쏙]](https://img.etoday.co.kr/crop/85/60/2285911.jpg)
![추운 날씨로 화장실 가는 횟수 늘었다?…“하루 8회 넘으면 배뇨장애 의심”[e건강~쏙]](https://img.etoday.co.kr/crop/85/60/2285843.jpg)


!['얼굴 천재' 차은우 사라졌다⋯스타 마케팅의 불편한 진실 [솔드아웃]](https://img.etoday.co.kr/crop/300/170/2285920.jpg)
![코스피 종가 기준 사상 최고치 기록... 4990선 상승 마감 [포토로그]](https://img.etoday.co.kr/crop/300/190/2285941.jpg)