국내 제약바이오 기업들이 미국과 유럽 등에서 개발 초기 단계의 의약품 후보물질의 임상시험을 적극적으로 추진하고 있다. 국내 기업들이 선진국 규제기관에 대한 대응역량과 기업 신뢰도를 부각할 수 있을지 주목된다.
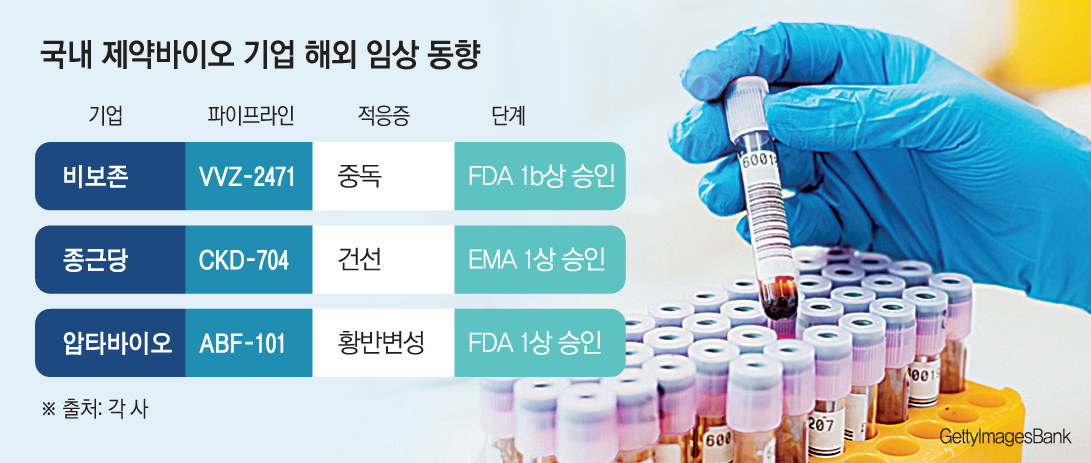
9일 제약바이오 업계에 따르면 비보존은 최근 신경병성 통증 치료 신약 후보물질 ‘VVZ-2471’에 대해 미국 식품의약국(FDA)으로부터 임상 1b상 시험계획(IND)을 승인받았다. VVZ-2471은 세로토닌 수용체 2A형(5-HT2A) 및 메타보트로픽 글루타메이트 수용체5(mGluR5)를 동시에 차단하는 이중 길항제(dual antagonist) 기전의 혁신 신약 후보물질이다. 신경계 흥분 조절을 통해 신경병성 통증을 완화하고 중독 관련 행동을 억제한다
이번 IND 승인을 통해 비보존은 미국 내 흡연자를 대상으로 약동학(PK) 및 안전성을 평가할 계획이다. 특히 향후 통증 외 중독성 질환 영역으로의 적응증 확장 가능성을 평가하기 위해 흡연 욕구 변화에 대한 탐색적 지표도 함께 분석한다는 목표다.
VVZ-2471은 미국 국립보건원(NIH) 산하 국립약물남용연구소(NIDA)의 오피오이드 사용장애(OUD) 치료제 개발 과제로 선정돼 중독 관련 적응증 확장을 위한 추가 임상 연구도 추진될 예정이다. 비보존은 현재 국내에서도 신경병성 통증 환자를 대상으로 하는 임상 2상을 진행 중이다.
종근당은 유럽의약품청(EMA)으로부터 건선 치료제 바이오시밀러 ‘CKD-704’(성분명 리산키주맙)의 임상 1상 IND를 최근 승인받았다. 리산키주맙은 면역 매개물질인 인터루킨(IL)-23의 일부를 차단해 염증 세포의 활성화를 억제하는 바이오의약품이다. 판상 건선과 건선성 관절염, 크론병, 궤양성 대장염과 같은 염증성 질환의 치료에 사용된다.
종근당은 유럽에서 건강한 성인 200여 명을 대상으로 CKD-704와 오리지널 제품인 ‘스카이리치’의 약동학적 동등성을 입증할 예정이다. 또한 안전성과 면역원성을 비교하는 연구도 진행할 계획이다. 또한 최근 자가면역질환 치료제 바이오시밀러 ‘CKD-706’의 유럽 임상 1상도 신청한 상태다.
스카이리치는 애브비가 스텔라라와 개발했으며, 애브비의 실적발표에 따르면 지난해 글로벌 시장에서 총 117억1800만 달러(16조9490억 원)의 매출을 기록했다.
압타바이오는 FDA로부터 염증·섬유화·신생혈관 생성 동시 차단 기전의 경구용 황반변성 치료제 ‘ABF-101’에 대한 임상 1상을 승인받았다. ABF-101은 체내 산화효소(NOX)를 억제해 염증·섬유화·신생혈관 생성을 동시에 차단하는 혁신신약 후보물질이다. 황반변성 치료의 표준요법은 혈관내피성장인자(VEGF) 억제 주사요법(IVT)과 비교해 투약이 쉽고 부작용 위험이 낮은 것이 특징이다.
이번 승인에 따라 압타바이오는 건강한 성인을 대상으로 하는 단일용량상승시험(SAD)과 중등도 및 진행성 황반변성(AMD) 환자를 대상으로 한 다중용량상승시험(MAD)을 통해 안전성, 내약성, 약동학을 평가할 예정이다. 또한 압타바이오는 현재 ABF-101와 동일 유효물질을 기반으로 한 점안제 제형 ABF-103을 함께 개발 중이다.
국내 제약바이오 기업들의 연구개발(R&D) 투자가 꾸준히 확대되면서 해외 연구도 활발해지는 추세다. 한국제약바이오협회에 따르면 국내 제약바이오 기업의 R&D 비용은 2018년 상장사 141곳 기준 총 2조4854억 원, 매출액 대비 비중은 11.2%로 집계됐다. 2022년에는 상장사 156곳이 총 4조3894억 원을 R&D에 투입했으며, 매출액 대비 비중은 12.7%로 파악됐다.



![평당 1억 원·연일 신고가…규제에도 ‘강남 불패’ [강남 집값 안잡나 못잡나 ①]](https://img.etoday.co.kr/crop/140/88/2283693.jpg)

![오천피 가시권…과열 논쟁 속 구조 변화 시험대 [ 꿈의 코스피 5000, 기대 아닌 현실 ①]](https://img.etoday.co.kr/crop/140/88/2283601.jpg)
![대기업·플랫폼도 흔들린다…‘책임 이사회’의 확산 신호 [이사회의 역설中①]](https://img.etoday.co.kr/crop/140/88/2283699.jpg)

![[단독] 통폐합 논쟁에 '숫자'로 맞선 신보⋯50년 보증 효과 첫 전수조사](https://img.etoday.co.kr/crop/140/88/2283710.jpg)



![삼성전자 주가 이제 겨우 '여기' 입니다. '여기까지' 열고 보세요 ㅣ 염승환 LS증권 이사 [찐코노미]](https://i.ytimg.com/vi/IZ_RFIDF4Po/mqdefault.jpg)

![[BioS]지아이이노, 아토피 ‘이중융합 에셋’ 특허 출원](https://img.etoday.co.kr/crop/85/60/1867895.jpg)








![[케팝참참] 현역가왕3, 아이돌·국악·전통 트롯까지…실력파 경쟁 본격화](https://img.etoday.co.kr/crop/300/170/2283644.jpg)
![코스피 '오천피까지 100포인트' [포토로그]](https://img.etoday.co.kr/crop/300/190/2283608.jpg)