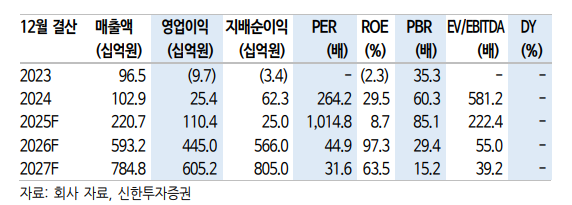
신한투자증권은 22일 알테오젠에 대해 매출과 이익이 큰 폭으로 성장할 것으로 전망했다. 파트너사 미국 머크(MSD)가 미국 식품의약국(FDA)에서 키트루다 피하주사(SC) 제형에 대한 품목 허가를 획득한 것이 호재로 작용할 것이라는 설명이다.
엄민용 신한투자증권 연구위원은 “20일 한국 바이오 역사상 최초로 국내 플랫폼이 전 세계 매출 1위 블록버스터 의약품에 장착돼 FDA로부터 승인받았다”며 “예정된 일정보다 3일 빠른 결정으로 출시도 10월 1일이 아닌 9월 말”이라고 밝혔다.
이어 “유럽도 내년 상반기에서 반기 빨라진 4분기 승인 예정으로, 전 세계 승인도 마무리 수순”이라며 “머크와 알테오젠 공동개발 제품은 ‘키트루다 큐렉스(Qlex)’로 출시될 예정이며, BMS·할로자임의 옵디보SC(5분), 로슈·할로자임 티쎈트릭(7분) 대비 가장 빠른 1~2분 투여가 가능하다”고 분석했다.
또 “티쎈트릭SC는 투여에 7분이 소요됨에도 영국 출시 9개월 말에 32% SC로 전환했다”며 “머크의 2년 내 30~40% 시장 SC 전환은 보수적 목표로 판단되며, 정맥주사(IV) 3주 제형과 6주 제형 동시 승인도 서프라이즈”라고 진단했다.
엄 연구위원은 “투여 6주 간격은 SC 제형 중 유일하며 BMS의 옵디보는 2~4주, 로슈의 티쎈트릭은 3주 간격만 SC가 승인됐다”며 “최근 유럽의약품청(EMA) 산하 약물사용자문위원회(CHMP)가 승인 권고를 발표하며 유럽도 4분기 승인이 유력해졌다”고 관측했다.
그는 “2021년 10월 임상 개시 이후부터 승인까지 만 4년이라는 유례없는 속도로 머스크는 사활을 걸고 진행 중”이라며 “이번 3분기 중 FDA 승인에 따른 수백억 원 단계별 마일스톤 인식 공시가 예상되며, 첫 판매 마일스톤이 알테오젠 4분기 실적에 바로 인식된다”고 강조했다.
그러면서 “이로써 알테오젠은 코스피 시장 이전을 위한 모든 조건을 마련했다”며 “빅파마와 연내 1~2건 기술 이전 목표를 유지 중으로, 이번 FDA 승인 여부가 계약 상대의 마지막 의사 결정 요소”라고 덧붙였다.


![이 대통령 “‘K자형 양극화’ 중대 도전…청년·중소·지방 정책 우선” [2026 성장전략]](https://img.etoday.co.kr/crop/140/88/2279662.jpg)

![[종합] 코스피, 사상최고치 4586.32 마감⋯6거래일 연속 상승 랠리](https://img.etoday.co.kr/crop/140/88/2274820.jpg)
![생산적금융 드라이브…'AI 6조·반도체 4.2조' 성장자금 공급 본격화 [2026 성장전략]](https://img.etoday.co.kr/crop/140/88/2228580.jpg)
![[단독] 인천공항 탑승객 줄세우는 스타벅스, 김포공항까지 접수](https://img.etoday.co.kr/crop/140/88/2279516.jpg)





![[테슬라 vs 엔비디아 2부] 테슬라 FSD 독주 잡으려는 엔비디아 알파마요! 소름돋는 젠슨 황의 큰 그림 ㅣ 강정수 블루닷AI 연구센터장 [찐코노미]](https://i.ytimg.com/vi/uVdj1rA4yVc/mqdefault.jpg)
![[오늘의 주요공시] HD현대마린엔진·한화·LG엔솔 등](https://img.etoday.co.kr/crop/85/60/2272682.jpg)


![[채권마감] 사흘만 약세, 외인 선물매도+환율 상승 부담](https://img.etoday.co.kr/crop/85/60/2279644.jpg)

![[환율마감] 달러 매수+엔화 약세…원·달러 1460원 목전 ‘보름여만 최고’](https://img.etoday.co.kr/crop/85/60/2279591.jpg)

![[급등락주 짚어보기] 알멕·비엠팜텍·러셀·모베이스전자 등](https://img.etoday.co.kr/crop/85/60/2279575.jpg)
![[장외시황] 싸이버로지텍, 41.54% 상승⋯케이뱅크 보합](https://img.etoday.co.kr/crop/85/60/2279572.jpg)
![[찐코노미] 테슬라 재도약 신호탄인가…엔비디아가 바꾼 자율주행 판](https://img.etoday.co.kr/crop/300/170/2279343.jpg)
![백화점3사 '설 선물세트' 예약 시작 [포토로그]](https://img.etoday.co.kr/crop/300/190/2279632.jpg)