
이중항체 전문기업 에이비엘바이오가 이중항체 항암제 ABL001(CTX-009/TR009/ES104/NOV1501)의 국내 단독 임상 1상 시험을 마무리했다고 28일 밝혔다.
국내에서 개발한 이중항체로는 최초로 국내 임상에 진입한 ABL001은 VEGF와 DLL4를 동시에 표적해 신생혈관형성을 억제함으로써 강한 항암효과를 유도한다.
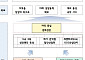
에이비엘바이오는 이번 임상에서 진행성 고형암 환자 45명에게 ABL001을 단독 투여해 9가지 용량에서의 안전성, 내약성 및 약동학적 특성을 평가해 최대내성용량 및 2상에서의 권장용량을 결정했다. 임상은 삼성서울병원, 서울아산병원과 분당서울대병원에서 이뤄졌다.
회사가 발표한 임상 결과보고서에 따르면, 최대 17.5mg/kg까지 투여했을 때 모든 용량에서 용량제한독성이 발생하지 않았고, 고혈압과 두통 등의 이상반응들도 VEGF를 타깃하는 여타 항체에서 보고된 결과들과 유사한 수준으로 발생했다. 또 말기 위암과 대장암 환자 3명이 종양 크기가 30% 이상 감소하는 부분관해를 보였다.
이상훈 에이비엘바이오 대표는 “국내 임상 1상에서 ABL001의 안전성 및 예비적 항암효과가 확인됐고, 해당 데이터는 향후 진행될 미국과 중국에서의 후속 임상시험의 근거로 활용될 것”이라며 “특히 최근 글로벌 파트너사인 트리거 테라퓨틱스를 흡수합병한 컴패스 테라퓨틱스가 하반기에 미국 임상시험계획서(IND)를 제출할 계획이고 중국 권리를 보유한 엘피사이언스 역시 중국에서의 임상을 계획하고 있는 만큼 ABL001의 시장확대가 기대된다”라고 말했다.
한편 에이비엘바이오는 현재 진행 중인 ABL001의 병용투여 임상 1b상 결과를 추후 학회를 통해 발표할 계획이다.




!['쌍란' 달걀의 진짜 정체 [에그리씽]](https://img.etoday.co.kr/crop/140/88/2269661.jpg)



![AI기술ㆍ인재 갖춘 印…글로벌 자본 몰린다 [넥스트 인디아 上-①]](https://img.etoday.co.kr/crop/140/88/2269145.jpg)



![[반도체 특집] 2026년 삼성전자와 SK하이닉스 주가 대폭발의 트리거는 '이것' ㅣ 염승환 LS증권 이사 ㅣ 이영훈 iM증권 이사 [찐코노미]](https://i.ytimg.com/vi/2KX841pw1so/mqdefault.jpg)


![대한제분, 대표 브랜드 ‘곰표’ 앞세워 ‘에그테크 코리아 2025’ 참가[에그리씽]](https://img.etoday.co.kr/crop/85/60/2269695.jpg)







!['통일교 특검'으로 뭉친 국민의힘-개혁신당 [포토로그]](https://img.etoday.co.kr/crop/300/190/2269538.jpg)