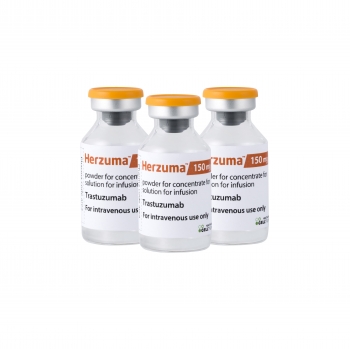
셀트리온은 최근 미국 식품의약국(FDA)에 허쥬마(CT-P6) 바이오의약품 품목허가를 위한 추가 보완자료를 공식 제출했다고 18일 밝혔다.
셀트리온은 작년 4월과 5월 FDA에 트룩시마와 허쥬마의 바이오의약품 품목허가를 각각 신청해 심사를 받아왔다. 하지만 최근 FDA로부터 지난해 5월 실시된 셀트리온 공장에 대한 FDA 정기실사 결과와 연관해 두 제품의 허가를 보류하는 CRL(Complete Response Letter)를 받은 바 있다.
셀트리온은 지난달 트룩시마(CP-T10)의 보완자료를 제출한데 이어 이달 허쥬마의 보완자료 제출까지 완료했다. 셀트리온 관계자는 "연내 허쥬마의 허가 심사를 완료하기 위해 총력을 기울이고 있다"고 설명했다. FDA는 바이오의약품 품목허가를 위한 추가 보완서류 접수 후 통상 6개월 이내에 해당 제품의 허가 심사를 마무리한다는게 회사측의 설명이다.
셀트리온은 트룩시마와 허쥬마의 미국 허가를 획득하게 되면, 두 제품의 미국 내 독점 판매 계약을 체결한 글로벌 대형제약사 테바(TEVA)를 통해 미국 시장에 조속히 선보인다는 계획이다.
셀트리온 관계자는 “이미 미국 시장에 진출한 램시마의 시장점유율이 꾸준히 확대되고 있는 만큼, 후속 제품 경쟁에서도 셀트리온 브랜드 가치와 기업 위상을 바탕으로 선발제품의 후광 효과를 누릴 것으로 기대하고 있다”면서 "허쥬마 판매 허가 및 론칭 시점을 앞당기기 위해 최선을 다하겠다”고 말했다.


![[단독] "고정금리 주담대 늘리려"…은행 새 자금조달 수단 나온다[한국형 新커버드본드]①](https://img.etoday.co.kr/crop/140/88/2213721.jpg)
![인도 18곳에 깃발…K-금융, 수출입 넘어 현지화로 판 키운다 [넥스트 인디아 下-②]](https://img.etoday.co.kr/crop/140/88/2270308.jpg)
![[AI 코인패밀리 만평] 커피값 또 오르겠네](https://img.etoday.co.kr/crop/140/88/2270302.jpg)

![캐즘 돌파구 대안으로…전기차 공백 메우기는 ‘한계’ [K배터리, ESS 갈림길]](https://img.etoday.co.kr/crop/140/88/2269002.jpg)





![2026년 원전 텐베거 잭팟주 후보! '이 주식'에서 노리세요! ㅣ 이영훈 iM증권 이사 [찐코노미]](https://i.ytimg.com/vi/73yJ8EsmQdM/mqdefault.jpg)










![[케팝참참] 공식 깨진 2025년 K팝…"신인이 주인공"](https://img.etoday.co.kr/crop/300/170/2270293.jpg)
!['통일교 특검'으로 뭉친 국민의힘-개혁신당 [포토로그]](https://img.etoday.co.kr/crop/300/190/2269538.jpg)